Neue Kinaseinhibitoren stoppen die Entzündung bei Lungengerüsterkrankungen
Überlegende antientzündliche Wirkung von narrow-spectrum protein kinase inhibitors (NSKI) in glatten Atemwegsmuskelzellen bei Chronisch-obstruktiver Lungenerkrankung (COPD)
BG Universitätsklinikum Bergmannsheil Bochum
Was bisher bekannt ist
In Deutschland leidet etwa 8 bis 12% der Bevölkerung an einer chronisch-obstruktiven Lungenerkrankung (COPD). Europaweit ist die COPD die dritthäufigste Todesursache. Ausgelöst wird die Erkrankung durch Rauchen und berufsbedingte Schadstoffexpositionen. Charakteristisch ist eine chronische Entzündung der Atemwege, welche über die Zeit zu einem Umbau der Lungenstruktur („Remodeling“) und schließlich zu einem Funktionsverlust der Lunge führt. Derzeit gibt es keine ursächliche Therapie – im Gegensatz zu anderen Entzündungen ist die COPD zumindest teilweise resistent gegenüber einzuatmenden (inhalativen) Cortison-Abkömmlingen (Corticosteroide). Dabei gibt es Cortikosteroid-resistente und Cortikosteroid-sensitive Entzündungsfaktoren.
Eine denkbare Alternative sind Hemmstoffe von Proteinkinasen (PTK), welche Entzündungsprozesse intrazellulär regulieren. Frühere klinische Studien haben allerdings gezeigt, dass die Hemmung einzelner PTK durch sogenannte single kinase inhibitors (SKI) aufgrund von Redundanzeffekten keine signifikante therapeutischen Wirkung erzielen. Andererseits sind bei der gleichzeitigen Hemmung vieler PTK nicht-tolerierbare Nebenwirkungen zu erwarten, da PTK an zentralen physiologischen Prozessen beteiligt sind.
Studiendesign und Resultate
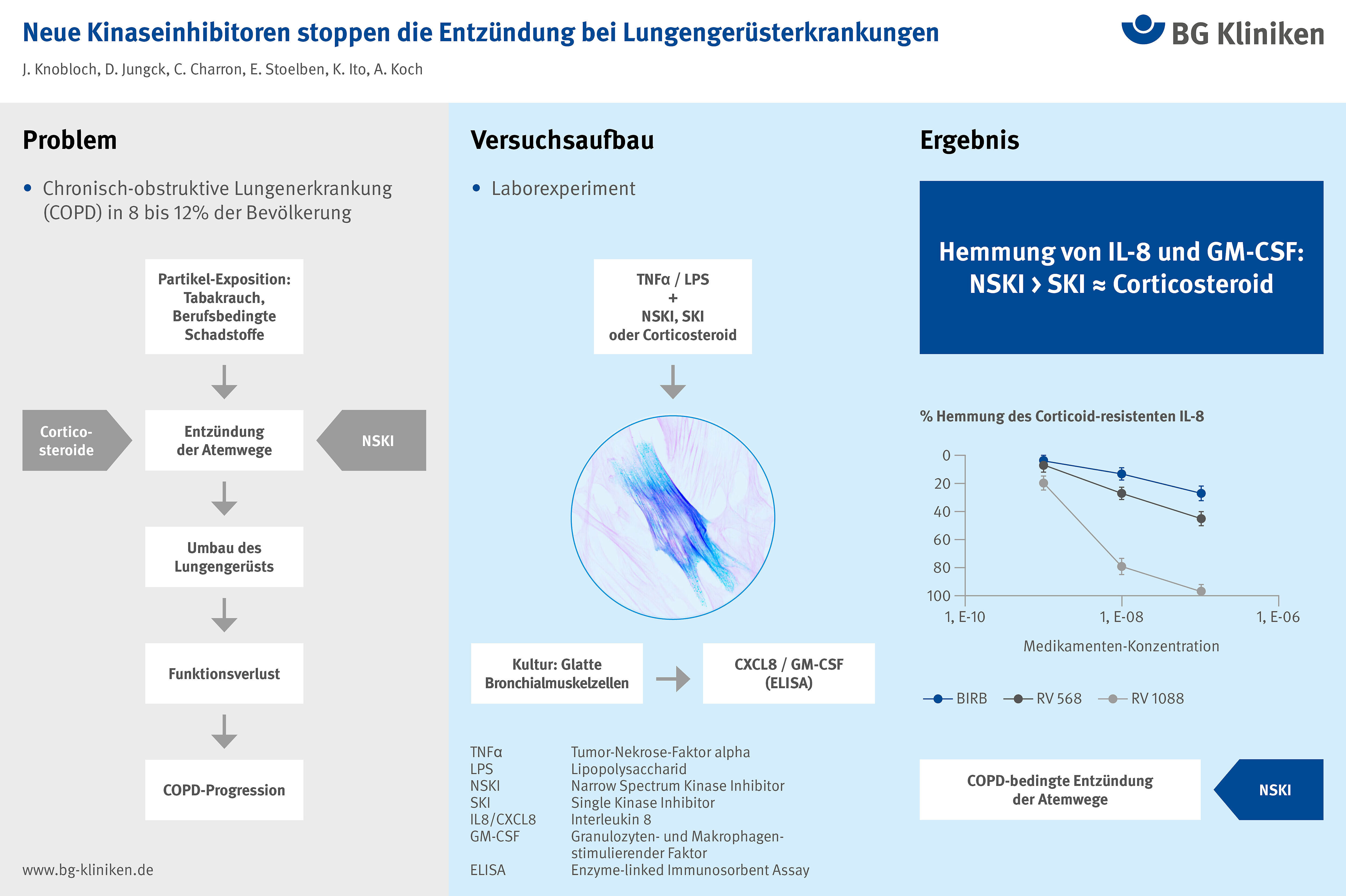
Das Ziel dieser vorklinischen Studie war es, in einem COPD-relevanten humanen Primärzellkulturmodell zu untersuchen, ob PTK-Inhibitoren, welche ein enges Spektrum von PTK hemmen (sogenannte narrow spectrum kinase inhibitors, NSKI), bezüglich ihrer anti-entzündlichen Wirkung SKI und Corticosteroiden überlegen sind.
Dazu wurden kultivierte primäre glatte Bronchialmuskelzellen (human airway smooth muscle cells, HASMC) von COPD-Patienten verwendet, weil dieses Zellkulturmodell die Corticosteroidresistenz der COPD-Entzündung widerspiegelt. Zudem sind HASMC zentrale Bausteine der Pathogenese der COPD. Die Zellen wurden mit Tumor-Nekrose-Faktor alpha (TNFα), einem zentralen Entzündungsvermittler, oder mit Lipopolysaccharid (LPS) stimuliert. Mit dem bakteriellen Endotoxin LPS werden Infekt-bedingte Verstärkungen der COPD-Entzündung simuliert. Im Überstand wurde die Produktion zweier weiterer COPD-Schlüsselfaktoren gemessen: das Corticosteroid-resistente Interleukin (IL) 8 und der Corticosteroid-sensitive Granulozyten- und Makrophagen-stimulierende Faktor (GM-CSF). Getestet wurden die Effekte der NSKI RV1088 (blockiert die PTK Src, Syk und p38MAPK) und RV568 (blockiert Src und p38MAPK), sowie der entsprechenden SKI.
Fluticason, ein Corticosteroid, das häufig in der COPD-Therapie eingesetzt wird, hemmte die TNFα-oder LPS-induzierte IL-8-Produktion nicht oder nur geringfügig. In Kontrollversuchen mit HASMC von Patientinnen und Patienten ohne COPD wurde hingegen eine deutliche und statistisch signifikante Hemmung beobachtet. RV1088 hemmte TNFα-induziertes IL-8 fast vollständig und war RV568 überlegen. Beide NSKI waren effektiver als die entsprechenden SKI und Fluticason.
Bedeutung für die klinische Versorgung und Forschung in den BG Kliniken
Diese Daten zeigen, dass NSKI Corticosteroid-resistente Entzündungsprozesse in einem COPD-relevanten Primärzellkulturmodell hemmen können. NSKI sind vielversprechende Kandidaten für die dringend benötigte ursächliche Therapie der COPD auch bei berufsbedingter Schadstoffexposition. Auf der Basis dieser und anderer vorklinischen Untersuchungen wurden bereits erste klinische Phase-I/II-Studien initiiert.
Über diesen Artikel
J. Knobloch
BG Universitätsklinikum Bergmannsheil BochumD. Jungck
C. Charron
E. Stoelben
K. Ito
A. Koch
Superior anti-inflammatory effects of narrow-spectrum kinase inhibitors in airway smooth muscle cells from subjects with chronic obstructive pulmonary disease. J Allergy Clin Immunol. 2018 Mar;141(3):1122-1124.e11. doi: 10.1016/j.jaci.2017.09.026. PMID: 29079133.